【重磅】mRNA聯合免疫療法創奇跡 腦膠質母細胞瘤治療進入新紀元
近日,西京醫院臨床免疫科、神經外科,空軍軍醫大學國家分子醫學轉化中心、細胞生物學教研室,啟辰生生物,約翰斯·霍普金斯大學醫學院藥理學與分子科學系,杜克大學醫學中心免疫學系的聯合研究團隊發表預印版論文,題為“Combination Immunotherapy of Glioblastoma with Dendritic Cell Cancer Vaccines, Anti-PD-1 and Poly I:C: A Case Report”(腫瘤mRNA-DC疫苗、抗PD-1和Poly I:C聯合免疫治療腦膠質母細胞瘤:一例病例報告)。提示該項研究對于聯合免疫療法在抗腫瘤治療領域的前瞻性和指導意義。

該研究是全球范圍內首次報告應用mRNA-DC疫苗、抗PD-1和poly I:C組成聯合免疫療法治療IV期腦膠質母細胞瘤(GBM),并且達到預期目標:“最大限度地提高治愈的可能性”,最終患者超過5年的無進展生存期結果令人鼓舞。研究中應用全新的TriVac技術對mRNA編碼的腫瘤抗原進行修飾,這也是mRNA技術優于多肽類疫苗的優勢之一。在臨床中TriVac技術修飾的mRNA表現出良好的安全性,并誘導出強大的抗腫瘤特異性CD4+和CD8+T淋巴細胞反應。該研究結果表明,聯合免疫療法可以長期進行,并且安全性和有效性也得到了驗證,為有效治療惡性程度極高的腦膠質母細胞瘤提供了新的臨床治療策略和實證支撐。研究中所用的抗腫瘤mRNA-DC疫苗由啟辰生生物研發,該產品已于今年10月18日獲得國家藥品監督管理局藥品評審中心(CDE)受理臨床試驗申請,是國內首個治療腦膠質母細胞瘤的mRNA-DC細胞疫苗,將為腦膠質母細胞瘤患者帶來新的希望。
腦膠質母細胞瘤是中樞神經系統最常見的原發惡性腫瘤,因其惡性程度極高被稱為“新癌王”。國家衛生健康委發布的《腦膠質瘤診療指南(2022年版)》顯示:我國腦膠質瘤年發病率為5~8/10萬,5年病死率極高,術后1年內高復發。腦膠質母細胞瘤作為一種起源于神經膠質細胞的腫瘤,約占所有中樞神經系統惡性腫瘤的80%,其發病率在全球范圍內持續上升。近年來在腦膠質母細胞瘤的治療上進展有限,患者的生存率很低,中位總生存期僅為13.5個月,是神經外科診療中最具挑戰性的疾病。
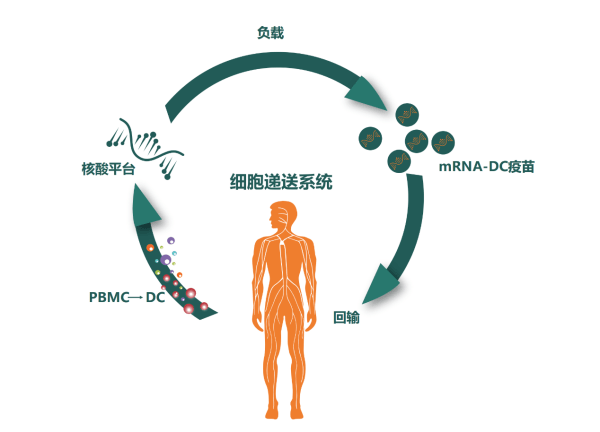
基于樹突狀細胞(DC)的腫瘤mRNA疫苗是一種非常有前途的GBM治療方法。DC是目前已知體內抗原遞呈功能最強的免疫細胞,也是特異免疫應答的啟動器,能高效攝取、加工、處理并呈遞抗原,是唯一能夠激活初始T細胞的專職抗原遞呈細胞,處于人體免疫應答的中心環節,因此被廣泛應用于癌癥治療。
該預印本文章報道的臨床研究,采用患者自體DC細胞裝載多種形式的腫瘤抗原(包括:編碼TAA的mRNA,新抗原的mRNA和次氯酸氧化腫瘤裂解物),并與其他免疫治療藥物(包括:抗程序性死亡受體1(PD-1)抗體、免疫佐劑聚肌苷酸胞苷酸(poly I:C)等)聯合使用,以進一步增強抗腫瘤活性。雖然此前有III期臨床研究應用抗PD-1納武單抗聯合放化療治療GBM,但未能達到提高總生存期的目標。本研究組合中,因成熟的DC細胞上調PD-L1和PD-L2,而且poly I:C激活免疫反應的同時也刺激PD-L1和PD-L2在GBM腫瘤細胞上的表達,因此有必要mRNA-DC腫瘤疫苗聯合抗PD-1以促進納武單抗阻斷PD-L1/2在成熟DC細胞和GBM腫瘤細胞上的抑制信號被遞送到T淋巴細胞。這是一種創新型的聯合免疫治療策略,在此之前尚無此種聯合使用方式的報道。
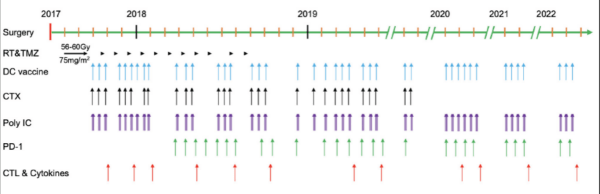
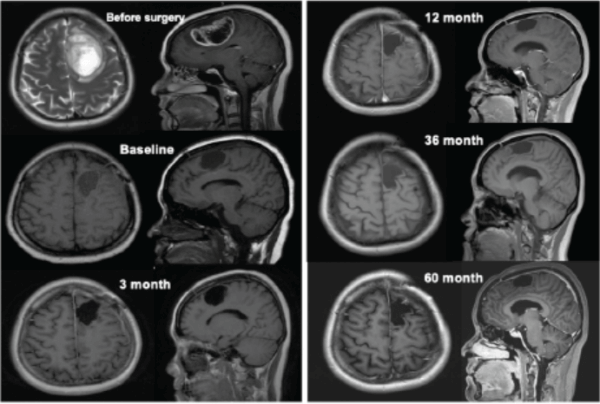
該患者的治療過程從2017年7月至2022年9月,超過5年,其中包括42次mRNA-DC腫瘤疫苗(連同poly I:C,每次mRNA-DC疫苗接種后給藥三次),以及抗PD-1藥物和低劑量環磷酰胺(以清除調節性T細胞)。臨床結果顯示,綜合免疫療法誘導出強大的抗腫瘤CD4+和CD8+T細胞反應,且在整個治療期間未觀察到免疫治療相關的不良事件。2022年7月21日的最近一次MRI掃描結果顯示沒有復發跡象。研究結果表明,整合到標準放化療中的聯合免疫療法對于長期治療GBM安全并有效。
值得關注的是,該臨床研究除了采用全球首例mRNA-DC腫瘤疫苗/抗PD-1/poly I:C聯合免疫治療GBM以外,還使用了一項全新的TriVac技術對腫瘤抗原進行功能修飾。該項技術由美國杜克大學和約翰斯·霍普金斯大學的科學家們發明,是將腫瘤抗原與一個不穩定結構域(DD)融合,同時將腫瘤抗原插入全長的溶酶體相關膜糖蛋白1(LAMP-1)中,以分別增強主要組織相容性復合體(MHC)I類和II類抗原的呈遞。臨床研究中使用了7種TAAs,其中5種TAA(SOX11、PIM1、SP17、SOX3和CSPG4)的結果顯示,第一階段未經此技術修飾其誘導的抗原特異性T細胞反應相對較弱,而第二階段經TriVac技術修飾后,誘導的抗原特異性T細胞反應大幅度增強。另外兩種TAAs(MTFR2和ADAMTSL1)使用了TriVac技術修飾,用于治療的第二階段,誘導出非常強的抗腫瘤特異T淋巴細胞反應。此結果表明TriVac技術在本次臨床試驗中有突出表現。
另一個值得關注的發現是,通過研究對于mRNA編碼TAAs的抗腫瘤實際應用有了新的認知。為了最大限度地提高患者治愈的可能性,本次臨床研究使用了三種類型的腫瘤抗原(mRNA-TAAs,mRNA-新抗原和次氯酸氧化裂解物)來負載自體DC細胞。使用這些抗原可以極大的相互補充其在腫瘤疫苗中的作用。次氯酸氧化腫瘤裂解物具有增強免疫原性的作用,但受限于難以從腫瘤組織中獲取足夠量的腫瘤抗原長期使用。本研究中患者的次氯酸氧化腫瘤裂解物僅足以支撐三次免疫接種,無法長期治療。相比之下,體外合成的mRNA編碼TAA和新抗原可以提供無限量的供應。在GBM治療中單獨使用新抗原會有兩個主要問題:第一,GBM較低的腫瘤突變負荷使可供選擇的新抗原很少。本研究預測的10種新抗原中,僅有4種(PRKRIR,FLGN,HUWE1和RUNX1)產生了等于或大于野生型抗原誘導出的特異性T細胞反應,被用于負載自體DC細胞進行免疫治療;第二,制造GMP級mRNA-新抗原并驗證免疫原性需要花費時間較長,通常需要3~6個月,而本次研究中使用的TAAs可預先制備,成本也極大降低。TAA免疫原性通過使用TriVac技術修飾等方法可有效增強MHC I類和II類抗原呈遞及T細胞刺激,遠高于單獨使用TAA,并在產品可及性上更具優勢。因此,考慮聯合使用mRNA-TAAs和mRNA-新抗原對于解決上述問題應是明智的選擇。
論文作者在討論中寫道:“本病例研究中我們觀察到幾個新穎的方面。第一,本病例代表了GBM治療中三種免疫治療藥物的首次聯合研究。盡管此前三種免疫治療藥物均已在GBM的治療中單獨進行過測試,但全球范圍內并沒有關于三者聯合使用的報道。第二,研究表明聯合免疫療法可以長期進行,并且安全性和有效性也得到了驗證。本次研究的目的是測試聯合免疫療法的安全性和耐受性,并最大限度提高治愈的可能性。該患者超過5年的無進展生存期的研究結果令人鼓舞。第三,不同形式的腫瘤抗原,包括mRNA-TAA、mRNA-新抗原和次氯酸氧化腫瘤裂解物,用于誘導抗腫瘤T淋巴細胞反應,可以相互補充,促進腫瘤治療性疫苗療效。第四,基于TriVac技術的腫瘤抗原修飾技術表現出良好的安全性,并且在患者體內誘導出強大的抗腫瘤特異性CD4+和CD8+T細胞反應。”
10月13日,美國mRNA疫苗制造商Moderna宣布與制藥企業默沙東合作,聯合開發并銷售一種個性化精準治療癌癥疫苗(PCV)mRNA-4157/V940,與默沙東的抗PD-1藥物帕博利珠單抗(Keytruda,K藥)聯用,探索治療高危黑色素瘤。10月16日英國《衛報》報道,德國生物技術公司BioNTech的創始人烏古爾﹒薩欣(U?ur ?ahin)和奧茲朗﹒圖雷利(?zlem Türeci)夫妻在接受BBC采訪時表示,針對癌癥的mRNA疫苗可能在2030年前上市。兩條消息引發全球對于mRNA腫瘤疫苗的廣泛關注。10月18日,國家藥品監督管理局藥品評審中心(CDE)官網信息,啟辰生生物科技(珠海)有限公司的靶向Survivin mRNA-DC細胞注射液臨床試驗申請(IND)已獲受理(受理號:CXSL2200520),成為國內首個獲得受理的腦膠質母細胞瘤治療性mRNA疫苗。國內mRNA-DC腫瘤疫苗的研發進度已處于和國際巨頭相當的水平。
未來攻克癌癥的策略是需要進一步提高腫瘤mRNA疫苗的有效性和安全性,對于癌癥等復雜性疾病,沒有一種技術手段可以解決全部問題,多學科綜合治療(MDT)的模式值得重視,聯合治療是必走之路。
推薦文章
-
發布時間:2025-04-07
-
發布時間:2025-04-07
-
發布時間:2025-04-07
-
發布時間:2025-04-07





